Alcanos
Características de los alcanos
Es la familia más simple de las sustancias orgánicas. Podemos decir que son como el “esqueleto” base de todos los compuestos que se estudian en la química orgánica; todos los demás compuestos orgánicos pueden considerarse como alcanos, a los que se han retirados o sustituido átomos o grupo de átomos.
- También llamados o conocidos como parafinas (en la antigüedad).
- Su representación general R-H (la “R” es la que sustituye al carbono).
- La formula general es CnH2n + 2 (fórmula para los alcanos de cadena abierta). Cn H2n (fórmula para los alcanos de cadena cerrada o cíclica).
- Se les llama alifáticos a los alcanos por ser los principales componentes de la grasa derivada del petróleo (tienen una apariencia muy similar a las grasas animales).
- Son saturados porque los alcanos se hayan enlazados a tantos hidrógenos como pueden, es decir, están llenos (saturados) de átomos de hidrogeno.
- Son apolares por lo tanto, son insolubles en agua y solubles en compuestos orgánicos.
- Son menos densos que el agua.
- Poseen altos puntos de ebullición y fusión los cuales aumentaran al aumentar el número de carbonos que posea el compuesto.
- Son poco reactivos (bastante estables).
- Presentan isómeros y una serie homologa.
Isomería: presente en la mayoría de compuestos orgánicos. Consiste en que a partir de la misma fórmula molecular o global se pueden formar o existen compuestos con estructuras diferentes.
Isomería estructural: poseen igual formula molecular pero diferente formula estructural.
Npentano (forma lineal), isopentano (forma de “L” al extremo), neopentano (forma de “+”).
Isómeros de posición: son compuestos que van a tener una variación de algún grupo en la cadena o algún sustituyente.
Isómero funcional: poseen igual formula molecular pero van a pertenecer a grupos funcionales diferentes.
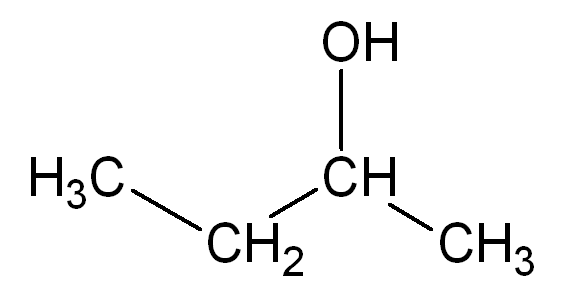
CH₃ - CH₂ CH₃ - O - CH₃ (METOXI METANO)
l (ETANOL)
OH
Serie homologa
Grupo de compuestos en los que sus miembros se diferencian del anterior y del posterior por el grupo metileno.
CH₄
CH₃ - CH₃
CH₃ - CH₂ - CH₃
CH₃ - CH₂ - CH₂ - CH₃
CH₃ - (CH₂)₃ - CH₃
CH₃ - (CH₂)₄ - CH₃
Un compuesto se distingue de su predecesor únicamente por poseer un carbono y 2 hidrógenos más, es decir, por poseer un grupo CH₂ (grupo metileno).
CH₄ = metano
CH₃ - CH₃ = etano
CH₃ - CH₂ - CH₃ = propano
CH₃ - CH₂ - CH₂ - CH₃ =butano
Nomenclatura IUPAC
La nomenclatura sistemática que vamos a estudiar es la que propuso: la Unión Internacional de Química Pura y Aplicada (IUPAC).
 |
| 4-etil- 5,6- dimetil undecano |
Este compuesto es sencillo y podemos decir que en este sistema se considera a los compuestos como cadenas lineales de átomos de carbono, las cuales pueden, en determinados casos, tener algunos átomos o grupos de átomos ocupando las posiciones de algunos de sus hidrógenos; es decir, sustituyendo a algunos hidrógenos; es decir, todo alcano es visualizado como constituido por una cadena principal y una serie de sustituyentes pendiendo de esta. Es segundo lugar el nombre de los compuestos consiste en tres partes: un prefijo, es un descriptor de los grupos sustituyentes y de su posición entre de la cadena principal. Nombre base, se refiere al número de carbonos que constituyen dicha cadena. Sufijo, indica a que familia de compuestos pertenece la sustancia que se está nombrando (en el caso del ejemplo terminara en “ano” porque pertenece a la familia de los alcanos).
Reglas especificas de la nomenclatura
- Se selección la cadena carbonada más larga, esta constituirá el nombre base del compuesto.
- Se numera la cadena desde el extremo que asigne los menores valores a los carbonos a los que se hallan enlazados los sustituyentes.
- Se listan los nombres de los sustituyentes indicando a la vez la posición de la cadena en la que están enlazados. Los sustituyentes carbonados reciben nombres análogos a los de sus alcanos correspondientes, csi se tienen on la única diferencia que el sufijo pasara de ser “ano” a “ILO”. De allí podemos decir que todos los grupos sustituyentes carbonados pertenecen a la familia de sustituyentes o radicales (alquilo). Si existen 2 o más sustituyentes iguales podemos permitirnos agruparlos a través del uso de prefijos numéricos: si son 2 di, 3 tri, 4 tetra, 5 penta, etc.
- Se integra el prefijo al nombre base y al sufijo del compuesto. Los sustituyentes que forman al prefijo se escriben en orden alfabético. Para el orden alfabético de los sustituyentes no se toma en cuente el prefijo de cantidad, aunque si se toman en cuenta los términos “ISO” y “NEO”.
- Cadenas con muchas matriz con igual número de carbonos se toma el que más sustituyentes tenga.
De esa manera el nombre del compuesto resulta ser: 4-etil-5,6-dimetil undecano.
Se elimina la “o” de los sustituyentes por estética.
Se utilizan únicamente guiones para separar los números de letras, se utilizan comas para separar los números de números.
No hay ningún guion que separe el nombre del sustituyente del nombre del compuesto base, ni al nombre del compuesto base de su sufijo.
- Si se tienen dos cadenas del mismo largo, se elige la cadena principal aquella que posee mayor número de sustituyentes.
- Si la numeración en un sentido de la cadena asigna los mismos valores a los carbones sustituidos que cuando se numera en sentido contrario, la dirección preferida se escoge en función del orden alfabético de los sustituyentes: manda el sentido que de el menor valor al sustituyentes que precede alfabéticamente al otro.
- Si el sustituyente esta a la vez sustituido, este se nombra siguiendo los mismos pasos que para nombrar al compuesto base a saber:
- Elige la cadena más larga del sustituyente ella le dará su nombre base.
- Se numera la cadena tomando como carbono “1” el que sale o el que está pegado a la cadena principal.
- Se identifican los grupos sustituyentes del sustituyente y sus posiciones dentro del mismo.
- Se integra el nombre a partir de la base y el prefijo dado por los sustituyentes para evitar confusiones, el nombre completo se encierra entre paréntesis, de esta manera aparecerá como una sola unidad.
 |
| 5-(1-etil propil) decano |
Reacciones de los alcanos
Los alcanos pueden presentar 2 tipos de reacciones:
- Halogenación: perdida de un átomo de hidrógeno y sustituido por un átomo de halógeno.
CnH₂n + 2 + X₂ --------- CnH₂n + 1x + Hx
- Combustión: se define como una oxidación acompañada con una liberación de energía y los productos van a depender de la cantidad de oxigeno presente en la reacción.
Hay 2 tipos de combustión:
- Incompleta: no hay suficiente cantidad de oxigeno.
- Completa: hay suficiente cantidad de oxigeno.
2 (Cn + H₂n + 1.5 (n) O₂ --- nCO₂ + H₂O + calor